
基本信息
李婷婷,博士,“潇湘学者”特聘教授,博士生导师,湖南省海外高层次人才,湖南省优青。以第一或通讯作者身份在Nature Communications、Journal of Clinical Investigation、PloS Pathogens、Cancer Research、Journal of Virology等国际权威期刊上发表多篇论文。出版专著 2 部,参编英文专著 1 部。主持国家自然科学基金面上基金和青年基金、湖南省教育厅重点项目等多项省部级以上课题。承担《生理学》等本科生教学工作,指导本科生获得全国生命科学创新创业大赛一等奖荣誉。
邮箱:tingtingli339@hunnu.edu.cn ; tingtingli339@gmail.com
招生方向:细胞信号转导与人类疾病(生理学 071003)
招聘信息:诚邀有生命科学和医学背景的硕士、博士研究生、博士后、助理教授(编制)及副教授(编制)加盟团队。
学习经历
2018年-2020年:美国匹兹堡大学,博士(导师:Shou-Jiang Gao教授)
2016年-2018年:美国南加州大学,博士在读(实验室搬迁)(导师:Shou-Jiang Gao教授)
2014年-2016年:美国南加州大学,硕士(导师:Shou-Jiang Gao教授)
2010年-2014年:湖南师范大学,学士
工作经历
2021年3月-至今,湖南师范大学生命科学学院
研究领域:肿瘤病毒感染与致瘤机制研究
病毒感染可导致人类约15%癌症的发生,其中卡波氏肉瘤病毒(KSHV)是卡波氏肉瘤(KS)、原发性渗出性淋巴瘤(PEL)和多中心Castleman病等肿瘤的病因。然而,KSHV诱导细胞恶性转化及癌变的分子机制尚不清楚,这种关键性知识缺陷严重阻碍了有效治疗方法的发展。目前,人们仅能通过抗病毒药物来抑制KSHV的复制,但却不能消除处于潜伏期的病毒。因此,预防KSHV感染、阐释KSHV致癌机理及研发针对潜伏期病毒的相关药物仍是研究中的重点和难点。本课题组将着力于KSHV致癌机制的研究,以病毒、代谢、药物研发与治疗方面的研究经历与专长为基础,结合学院及实验室现有科研平台,围绕国家重点研发计划重点专项与研究院前沿技术的需求,就具体疾病及相关药物疗效开展研究工作,并计划将基础研究成果向临床应用推进。具体研究内容包括:
A. KSHV急性感染及裂解再激活的分子机制研究
1) 鉴定KSHV急性感染依赖或激活的细胞通路或限制因子
通过蛋白组学、转录组学及表观遗传组学修饰的变化来鉴别病毒急性感染所导致的宿主基因表达和通路的变化,从而鉴定KSHV急性感染所需的病毒及宿主细胞基因,并以此为科学依据,开发新的干扰病毒感染的药物。

图1:DSF抑制KSHV原发性感染大鼠后肾间充质干细胞。
2) 揭示KSHV裂解再激活的分子机制
KSHV生命周期包括潜伏期和裂解期。潜伏期是急性感染后默认的KSHV复制程序,对于KS及PEL的发生及发展至关重要。在病毒潜伏期,KSHV表达有限数量的病毒基因,并以附加体(episome)的形式持续存在于宿主细胞核内,从而逃避免疫监视。相比之下,KSHV在裂解复制期产生大量病毒蛋白和感染性病毒粒子,通过传播感染和调节细胞内外环境的方式来促进KS及PEL的发展。因此,阐明调控KSHV潜伏期和裂解再激活的分子机制具有重要的科学意义。为了揭示KSHV维持潜伏期的分子机制,我们将采用反向遗传学方法对KSHV重组病毒进行突变,同时结合CRISPR-Cas9全基因组筛选技术,鉴定维持KSHV潜伏期所必须的病毒及宿主基因,并揭示其发挥作用的分子机制。目前,课题组正在进行的工作已经鉴定出调节KSHV生命周期的代谢途径,接下来我们将进一步鉴定调节病毒复制某一阶段的特异性营养物质及代谢传感器,并揭示其作用机制。
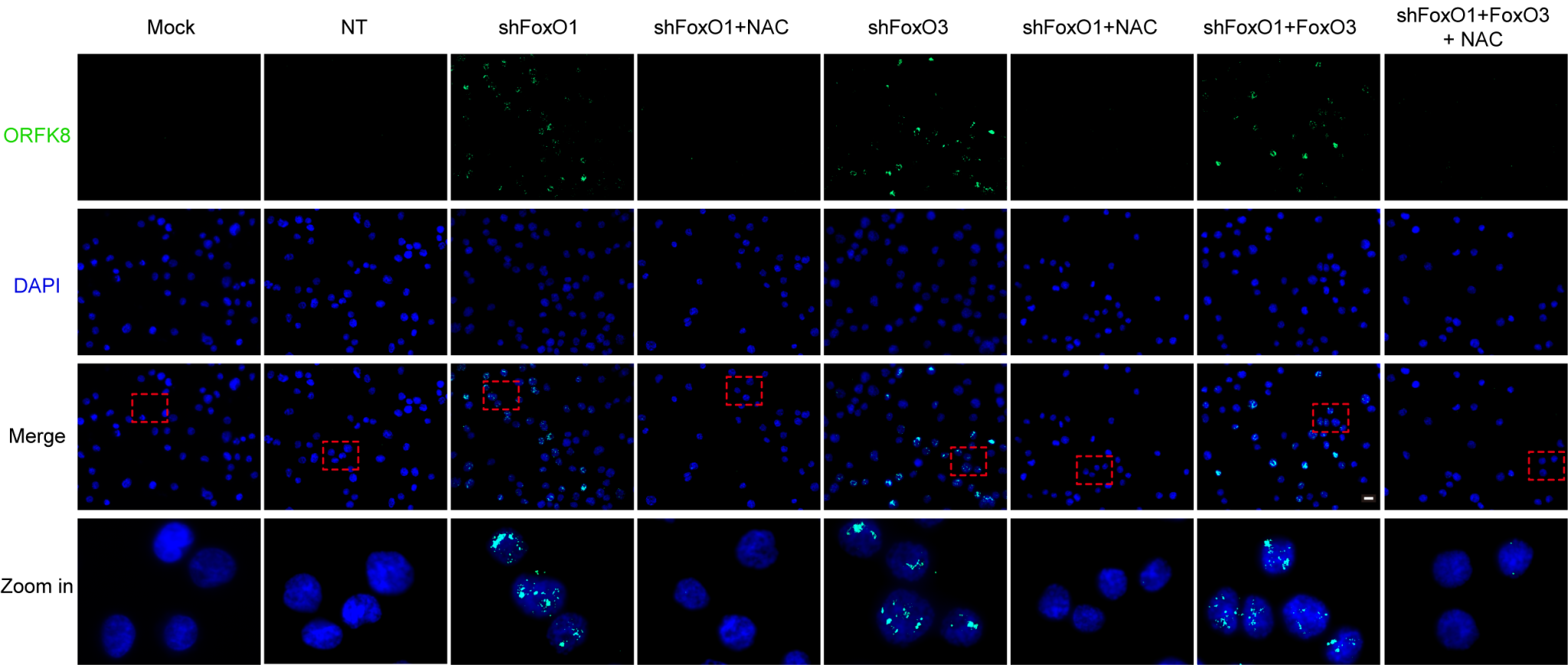
图2: FoxO1或FoxO3敲低以ROS依赖性方式诱导KSHV裂解再激活。
B. KSHV致癌的分子机制研究
阐明KSHV诱导炎症、血管生成、细胞转化和肿瘤发生的分子机制。具体来说,我们将研究KSHV如何重新编程可能导致这些恶性表型的细胞表观基因组、转录组、代谢组和信号通路。
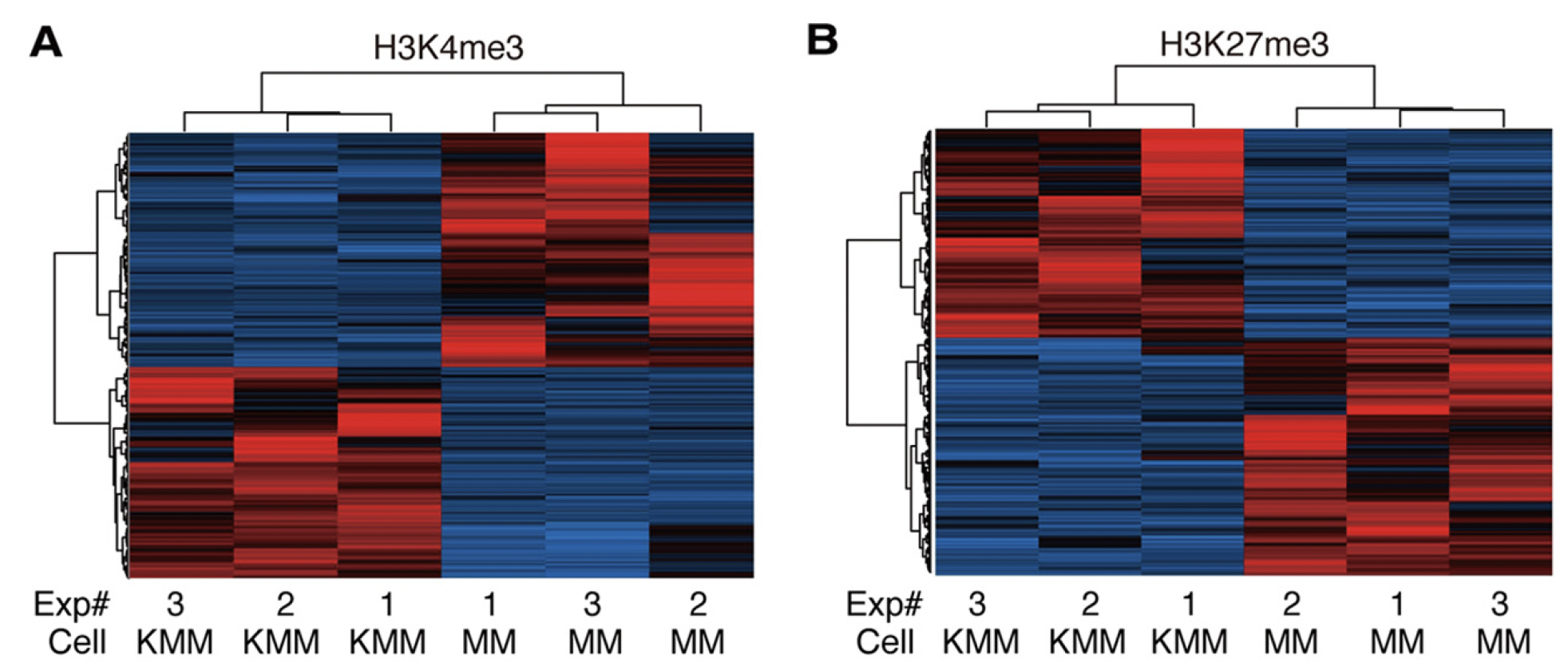
图3:KSHV显著改变宿主细胞中的组蛋白修饰方式。(A) MM和KMM细胞中组蛋白H3K4me3修饰的热图;(B) MM和KMM细胞中组蛋白H3K27me3修饰的热图。
实验室成员
李冠亚,2019级,博士生
许多,2021级,硕士生
王叶情,2022级,博士生
王丽洁,2022级,硕士生
唐心雨,2022级,硕士生
成金,2023级,博士生
徐泽宇:2023级,硕士生
闫鸿:2023级,硕士生
蓝俊刚:科研助理(2020级,硕士生)
科研项目
1. 国家自然科学基金面上项目(82372247,2024年-2027年)
2. 国家自然科学基金青年项目(82102387,2022年-2024年)
3. 湖南省自然科学基金优秀青年项目(2022JJ20033,2022年-2024年)
4. 湖南省教育厅重点项目(22A0035,2022年-2024年)
5. 湖南师范大学特聘教授启动经费(2022年-2027年)
科研获奖
湖南省优青,2022年
湖南省海外高层次人才青年项目,2021年
全国大学生生命科学创新创业大赛,一等奖,指导老师,2022年
代表性论文(第一作者或通讯作者)
1. Li T, Wang X, Ju EG, Zhang XQ, da Silva SR, Gao S-J*. RNF167 activates mTORC1 and promotes tumorigenesis by targeting CASTOR1 for ubiquitination and degradation. Nature Communications, 2021, 12:1055.(中科院一区,IF: 16.6)
2. Li T, Ju EG, Gao S-J*. Kaposi sarcoma–associated herpesvirus miRNAs suppress CASTOR1-mediated mTORC1 inhibition to promote tumorigenesis. Journal of Clinical Investigation, 2019, 130: 3310-3323.(中科院一区,IF: 15.9)
3. Yue S, Li G, He S*, Li T*. The central role of mTORC1 in amino acid sensing. Cancer Research, 2022, 82 (17): 2964–2974.(中科院一区,IF: 11.2)
4. Lan J, Wang Y, Yue S, Xu D, Li Y, Peng X, Hu J, Ju E, He S*, Li T*. Targeting FoxO proteins induces lytic reactivation of KSHV for treating herpesviral primary effusion lymphoma. Plos Pathogens, 19(8): e1011581.(中科院一区,IF: 6.7)
5. Li T*, Gao SJ*. KSHV Hijacks FoxO1 to Promote Cell Proliferation and Cellular Transformation by Antagonizing Oxidative Stress. Journal of Medical Virology, 2023, 95(3): e28676.(IF: 12.7)
6. Li G #, Xiao K#, Li Y, Gao J, He S*, Li T*. CHIP promotes CAD ubiquitination and degradation to suppress the proliferation and colony formation of glioblastoma cells. Cellular Oncology, in revision.(中科院二区,IF: 6.6)
7. Li T, Zhu Y, Cheng F, Lu C, Jung JU, Gao S-J*. Oncogenic Kaposi’s Sarcoma-associated herpesvirus upregulates argininosuccinate synthase 1, a rate-limiting enzyme of the citrulline-nitric oxide cycle, to activate the STAT3 pathway and promote growth transformation. Journal of Virology, 2019, 93: e01599-18.(中科院二区,IF: 5.4)
8. Li T, Gao S-J*. Metabolic reprogramming and metabolic sensors in KSHV-induced cancers and KSHV infection. Cell and Bioscience, (2021) 11:176.(中科院二区,IF: 7.5)
发表论文链接:https://scholar.google.com/citations?hl=en&user=id0qpnMAAAAJ
