氧化应激是影响肠道健康的重要因素之一,它可通过破坏肠道屏障功能、扰乱肠道微生物群平衡,进而诱发炎症和细胞死亡[1-3]。氧化应激在肠道疾病、代谢紊乱、神经退行性疾病和衰老进程中均起着核心作用[4-7]。因此,如何缓解氧化应激并维持肠道稳态已成为当前肠道健康研究领域的重要方向。氨基酸作为机体代谢的重要调节因子,近年来在应对氧化应激机制研究中受到越来越多的关注。天冬氨酸(Aspartate, Asp)是一种非必需氨基酸,但其在核苷酸合成、尿素循环、TCA循环、谷胱甘肽合成及线粒体能量代谢等方面发挥着重要作用[8]。已有研究表明,天冬氨酸能够在某些病理条件下表现出抗氧化和抗炎作用。然而,目前关于Asp如何缓解仔猪慢性氧化应激的具体机制仍未被充分揭示。
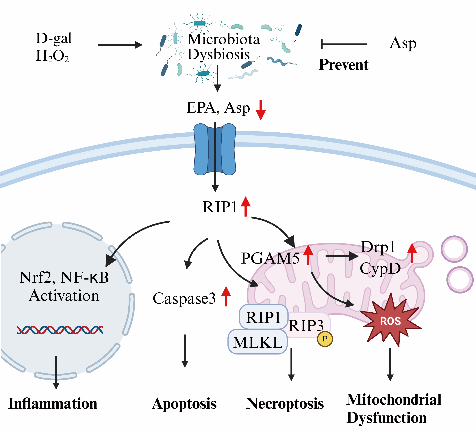
2025年1月28日,湖南师范大学印遇龙院士科研团队在Advanced Science发表了题为 “Aspartate metabolism-driven gut microbiota dynamics and RIP-dependent mitochondrial function counteract oxidative stress” 的研究论文。该研究表明随着慢性氧化应激的持续,仔猪肠道微生物群缓慢紊乱,肠道微生物群失调进一步加剧了氧化损伤。天冬氨酸的保护作用是一个多因素过程,会协同影响仔猪的生长和抗氧化应激。天冬氨酸代谢通过RIP通路动态调节肠道微生物群和线粒体功能,从而保护肠道免受氧化损伤。

为了研究Asp在缓解慢性氧化应激中的作用,作者使用D-半乳糖(D-Galactose, D-Gal)诱导断奶仔猪建立慢性氧化应激模型,以评估慢性氧化应激对仔猪生长性能、免疫功能和肠道微生物群的影响。实验结果显示,D-gal处理导致仔猪体重显著降低,日增重和日采食量减少,表明慢性氧化应激损害了其正常的生长发育。此外,流式细胞技术分析显示T细胞比例下降,CD4+/CD8+比值升高,提示机体免疫稳态失衡,炎症调节能力受损。同时,作者观察到D-gal诱导的慢性氧化应激还引起肠道微生物群的动态变化。在实验的不同时间点(第7、14、21和28天),D-gal处理的仔猪肠道微生物群呈现明显的时间依赖性变化,并随着氧化应激的持续加剧,菌群组成逐步失衡。这些结果表明,慢性氧化应激不仅抑制生长和免疫功能,还改变了肠道微生物的组成。粪便代谢组学分析进一步揭示了慢性氧化应激对代谢稳态的破坏。慢性氧化应激导致多种代谢通路包括P450代谢、泛酸和辅酶A生物合成、苯丙氨酸/酪氨酸/色氨酸代谢等出现差异,说明慢性氧化应激影响了关键营养物质的代谢。特别值得注意的是,D-gal处理显著降低肠道和血清中Asp水平,且上述出现的差异代谢物和差异菌株均与Asp呈现显著相关性,提示慢性氧化应激可能导致天冬氨酸代谢紊乱,迫使机体需要更多的Asp或合成代谢受阻,进而影响能量代谢和抗氧化防御。
为了验证补充天冬氨酸对氧化应激损伤的缓解作用,作者设立了0%、0.25%、0.5% 和1.0% Asp低蛋白膳食组,并评估其对断奶仔猪生长和代谢的影响。结果表明,0.5% Asp组的仔猪体重、平均日增重和平均日采食量显著提高,而1.0%天冬氨酸组的平均日采食量反而下降,提示过量Asp可能影响采食量进而抑制其生长,0.5% Asp为优化剂量。此外,Asp补充增强了仔猪免疫功能,显著提高CD3+ T细胞比例,降低CD4+/CD8+比值,表明Asp通过调控T细胞亚群改善了免疫稳态。组织学分析显示,Asp处理增加了小肠绒毛高度,提高了线粒体数量和ATP生成,有助于维持肠道能量代谢和屏障功能。
在IPEC-J2细胞实验中,作者进一步探索了Asp对仔猪肠道上皮细胞的直接作用。细胞增殖实验表明,0.1mM Asp处理可显著提高细胞活力,增强线粒体代谢效率。此外,Asp处理显著增加线粒体最大呼吸速率和ATP生成,表明其可促进线粒体能量代谢。同时,Asp通过上调PCNA(增殖细胞核抗原)表达,降低乳酸脱氢酶水平,减少细胞损伤,抑制Caspase-3介导的细胞凋亡,进一步证实了Asp对细胞增殖的促进作用及其抗氧化保护效果。
在氧化应激条件下,Asp处理还调控仔猪肠道菌群平衡,增强抗氧化能力。D-gal 处理后的0.5% Asp组仔猪血清ROS和MDA水平显著降低,而抗氧化酶GSH-Px和SOD活性显著提高。在补充Asp之后,肠道菌群的动态变化逐渐恢复稳态。与D-gal组相比,0.5% Asp处理组在第21和28天有益菌Ruminococcaceae和Prevotella丰度显著提高,同时显著降低因慢性氧化应激引发的Megasphaera丰度的升高。这种恢复趋势表明,Asp能够调控肠道微生物群在氧化应激条件下的动态变化,并促进肠道稳态的恢复。此外,代谢组学分析显示Asp处理可显著提高二十碳五烯酸(Eicosapentaenoic acid, EPA)水平,提示EPA可能通过调控肠道微生物群在抗氧化过程中发挥作用。进一步实验验证表明,EPA处理可降低ROS生成,提高SOD和GSH-Px活性,并减少MDA积累,增强机体的抗氧化防御能力。作者还证明Asp缓解氧化应激的机制可能涉及RIP3-MLKL和RIP1-Nrf2-NF-κB信号通路。
为了进一步验证Asp在RIP3-MLKL和RIP1-Nrf2-NF-κB信号通路中的作用,作者进行了RIP1靶向抑制剂抑制和过表达(OE-RIP1)实验的双重证明。结果显示,RIP1靶向抑制后可使线粒体中ROS水平显著增加,并添加Asp也依然改不了ROS的升高和RIP3-MLKL介导的细胞坏死。而RIP1过表达显著抑制IPEC-J2细胞增殖。此外,MitoTracker染色和Western blot结果显示,OE-RIP1组线粒体形态异常,p-RIP3和MLKL水平升高,表明RIP1过表达诱导线粒体应激并激活细胞坏死性凋亡。值得注意的是,Asp处理可逆转这些负面影响,并降低p-RIP3和MLKL表达,说明Asp可通过抑制RIP1介导的坏死性凋亡,减少氧化应激损伤。
综上所述,本研究对Asp代谢与肠道微生物群之间的动态相互作用进行了多层次的全面剖析,并揭示了Asp介导依赖于RIP的线粒体功能来缓解氧化应激的新机制。这些发现意味着氨基酸代谢与参与氧化应激的肠道微生物功能之间存在着复杂且关键的联系,这可能有助于设计未来针对慢性氧化应激相关疾病的干预策略。此外,这些研究还强调了Asp在治疗和预防与氧化应激有关的胃肠道疾病方面的潜力,突显了饮食Asp在维护肠道健康方面的必要性。了解这些新机制为针对氧化应激相关慢性疾病的靶向疗法开辟了新途径。这些发现的临床意义,尤其是对人类健康的意义,值得进一步深入探讨,以验证Asp在疾病预防和管理策略中的重要作用。
该论文由湖南师范大学何流琴教授和中国科学院亚热带农业生态研究所印遇龙院士及李铁军研究员为通讯作者,博士研究生金顺顺、吴建和王晨昱为第一作者。该研究得到了国家自然科学基金委创新发展联合基金重点项目(U23A20233)、国家自然科学基金委重点基金和面上基金项目(32130099和 32172755)、湖南省科技创新领军人才项目(2023RC1054)、湖南省重大基础研究项目(2024JC0007)、国家生猪产业技术体系(CARS-35)等项目的资助。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202404697
通讯作者简介:

印遇龙,中国工程院院士,全国人大代表,博士生和博士后导师。现任中国科学院亚热带农业生态研究所研究员,畜禽养殖污染控制与资源化技术国家工程实验室主任,中国农学会微量元素与食物链分会理事长,世界中医药学会联合会芳香产业分会名誉理事长,Animal Nutrition 杂志主编, Animal Diseases副主编, The Innovation Life副主编,iMeta,Journal of Animal Science(2017-2020),Domestic Animal Endocrinology(2007-2009)和中国科学 生命科学中英文版编委。长期从事猪健康养殖研究,先后主持完成院、省、国家、国际合作科研项目30多项。在PNAS、CNS 子刊等刊物发表高质量论文300多篇,所有英文论文被引用60000多次, H-index in Google Scholar 111,以第一完成人获国家科技进步奖二等奖二项和国家自然科学奖二等奖一项, 曾获湖南省杰岀贡献奖,何梁何利科技进步奖,2018年在澳大利亚布里斯班举行的第14届国际猪消化生理学大会上获Asia-Pacific Nutrition Award (杰出成就奖)。

何流琴,教授,博士生导师,中国畜牧兽医学会动物营养学分会理事和中国饲料工业协会标准委员会委员。入选国家“万人计划”青年拔尖人才、湖南省科技领军人才、中国科协青年托举人才工程、湖湘青年英才、湖南省优青等人才项目。长期从事仔猪肠道健康与氨基酸营养调控研究,主持十四五国家重点研发计划课题,国家自然科学区域创新联合重点基金、面上基金和青年基金,湖南省重点研发等省部级以上项目10余项。近五年以第1作者或通讯作者身份在Molecular Therapy、Gut Microbes、Advanced Science 等国际动物营养领域著名学术期刊发表SCI论文近40余篇,且在《中国科学•生命科学》和《科学通报》等国内顶级杂志发表 20余篇,参编或主编中英文专著8部。以第一发明人授权欧洲等国际专利8项和国内专利12项,软件著作权14项,并实现多项发明专利的成果转化。荣获湖南省青年科技奖、中国农学会青年科技奖、中华环保联合会科技进步特等奖、神农中华农业科技一等奖、省科技进步二等奖、大北农科技一等奖和神农中华优秀创新团队奖各1项,并获得中国畜牧兽医学会第六届井冈山新秀奖、动物营养学分会“帝斯曼缤纷科技奖”和第三届青年学者“优胜奖”及农业农村部重点实验室“颐和青年新锐奖”等荣誉。

李铁军,博士生导师,中国科学院亚热带农业生态研究所研究员,山东省泰山产业领军人才工程蓝色人才,国家生猪产业联盟副理事长。长期从事生猪氨基酸营养与健康养殖研究。作为主要研究人员获得国家科技进步二等奖2 项,省部级科技进步一等奖5 项(2006年度、2009年度、2011年度、2015年度和2018年度)、省部级自然科学一等奖1 项,省部级科技进步二等奖3 项(1995年度、2007年度和2011年度),以及2021年度神农中华农业科技奖优秀创新团队奖。主持国家973 课题1项,十四五国家重点研发计划课题1项,国家自然科学基金面上项目3项,省部级科研项目7项。近5 年来,发表研究论文90篇,SCI 收录论文中他引总次数752 次,单篇他引最高次数73 次,其中以通讯作者发表SCI 收录论文40 篇;授权专利6项;授权软件著作权9项
参考文献:
[1] Z. A. Bhutta, J. A. Berkley, R. H. Bandsma, M. Kerac, I. Trehan, A. Briend, Nat. Rev. Dis. Primers 2017, 3, 17067.
[2] B. Wen, J. M. Njunge, C. Bourdon, G. B. Gonzales, B. M. Gichuki, D. Lee, D. S. Wishart, M. Ngari, E. Chimwezi, J. Thitiri, L. Mwalekwa, W. Voskuijl, J. A. Berkley, R. H. Bandsma, Sci. Adv. 2022, 8, eabj6779.
[3] W. Tang, J. Wu, S. Jin, L. He, Q. Lin, F. Luo, X. He, Y. Feng, B. He, P. Bing, T. Li, Y. Yin, Sci. China Life Sci. 2020, 63, 116.
[4] S. Shandilya, S. Kumar, N. Kumar Jha, K. Kumar Kesari, J. Ruokolainen, J. Adv. Res. 2022, 38, 223.
[5] S. Spahis, J.-M. Borys, E. Levy, Antioxid. Redox Signaling 2016, 26, 445.
[6] V. E. Brunt, R. A. Gioscia-Ryan, J. J. Richey, M. C. Zigler, L. M. Cuevas, A. Gonzalez, Y. Vázquez-Baeza, M. L. Battson, A. T. Smithson, A. D. Gilley, G. Ackermann, A. P. Neilson, T. Weir, K. P. Davy, R. Knight, D. R. Seals, Physiol. J. 2019, 597, 2361.
[7] C. Weber, Nat. Rev. Gastroenterol. Hepatol. 2015, 12, 429.
[8] J. M. Borkum, Adv. Biol. 2023, 7, 2300095.
